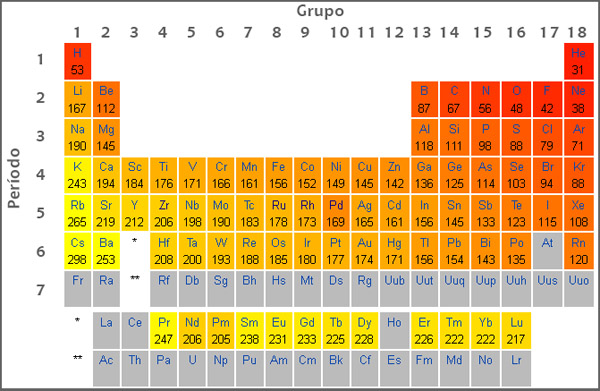
A tabela periódica é uma das ferramentas mais importantes e fundamentais da química, pois organiza os elementos químicos de acordo com suas propriedades e características. Neste artigo, vamos desvendar os mistérios por trás da tabela periódica de forma descomplicada, para que você possa entender melhor a química e se destacar nos estudos.
A tabela periódica é composta por linhas horizontais, chamadas de períodos, e colunas verticais, chamadas de grupos. Cada elemento químico é representado por um símbolo e possui um número atômico, que corresponde ao número de prótons no núcleo do átomo. Além disso, os elementos estão organizados de acordo com suas propriedades químicas e físicas, o que facilita a compreensão das relações entre eles.
Um dos conceitos mais importantes da tabela periódica é a periodicidade das propriedades dos elementos. Isso significa que as propriedades dos elementos variam de forma regular e previsível ao longo da tabela, de acordo com a sua posição. Por exemplo, a eletronegatividade dos elementos aumenta conforme avançamos da esquerda para a direita e de baixo para cima na tabela periódica.
Além disso, a tabela periódica é dividida em metais, ametais e semimetais, de acordo com suas propriedades. Os metais são bons condutores de eletricidade e calor, enquanto os ametais tendem a formar compostos iônicos ou moleculares. Já os semimetais possuem propriedades intermediárias entre os metais e os ametais.
Outro conceito importante relacionado à tabela periódica é a distribuição eletrônica dos elementos. Os elétrons dos átomos estão distribuídos em camadas ou níveis de energia ao redor do núcleo. Cada camada pode conter um número máximo de elétrons, de acordo com a regra do octeto. Por exemplo, o oxigênio possui o número atômico 8 e sua distribuição eletrônica é 2-6, ou seja, possui 2 elétrons na primeira camada e 6 elétrons na segunda camada.
Além disso, a análise da tabela periódica também nos permite prever as propriedades dos compostos formados pelos elementos. Por exemplo, os elementos do grupo 1 tendem a formar compostos iônicos com um elétron a menos em sua camada de valência, enquanto os elementos do grupo 17 tendem a formar compostos iônicos com um elétron a mais em sua camada de valência.
Em resumo, a tabela periódica é uma ferramenta fundamental para a compreensão da química, pois organiza os elementos de forma lógica e previsível, de acordo com suas propriedades e características. Ao estudar a tabela periódica de forma descomplicada, você poderá compreender melhor a química e se destacar nos estudos. Portanto, dedique um tempo para explorar e entender a tabela periódica, pois ela será sua aliada no aprendizado da química.